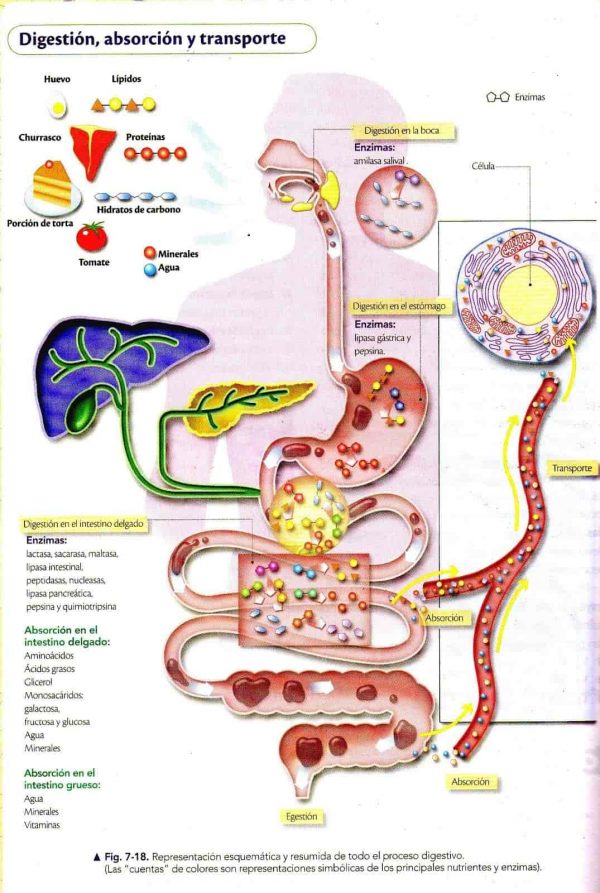
En el día de hoy vamos a explicar el proceso completo que realiza nuestro organismo desde que ingerimos proteínas a través de la dieta hasta que finalmente son excretadas. Anteriormente, ya habíamos comentado qué son las proteínas, cuál es su composición y los diferentes tipos de proteínas que tiene nuestro organismo. Ahora bien, el cuerpo no puede absorber las proteínas tal y como las ingerimos, necesita realizar una serie de procesos de digestión y degradación en el estómago e intestino para descomponerla en elementos más pequeños (aminoácidos y péptidos) que ahora si pueden ser absorbidos y aprovechados por nuestro cuerpo. Una vez son absorbidos en el intestino por los enterocitos, pasan al torrente sanguíneo y a través de la vena porta llegan al hígado. El hígado es el encargado de realizar las funciones de transaminación, desaminación oxidativa y ciclo de la urea. A través de estos procesos metabólicos podemos utilizar las cadenas carbonatadas de los aminoácidos para producir energía, sintetizar lípidos o realizar la glucólisis (a través de una molécula de glucosa producimos energía en forma de ATP) y cetogénesis (catabolismo de ácidos grasos para formar cuerpos cetónicos utilizados en el ciclo de Krebs para producir energía). Durante la metabolización de los aminoácidos se produce NH3 (amoniaco) muy toxico para nuestro organismo que es transformado en Urea a través del ciclo de urea. La urea menos tóxica viaja hasta los riñones encargados de filtrar las sustancias toxicas de la sangre para finalmente convertirse en orina.
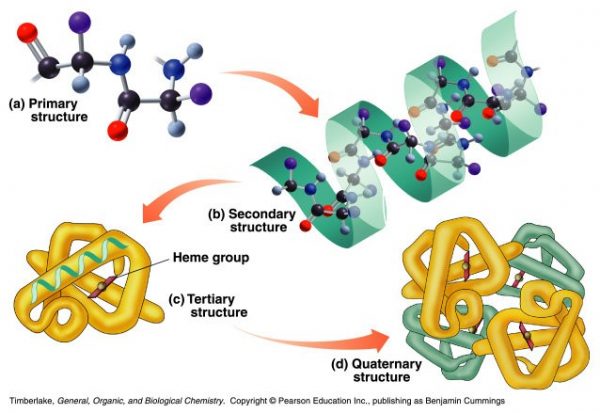
A modo de resumen, una proteína es una estructura molecular tridimensional formada por cadenas de aminoácidos. Las proteínas poseen 4 estructuras: primaria, secundaria, terciaria y cuaternaria.
La estructura terciaria de las proteínas es la que las dota de su actividad biológica. La actividad biológica es la función que realiza en nuestro organismo. Las proteínas tienen un papel importantísimo en nuestro cuerpo: desde funciones de transporte como la hemoglobina (proteína transportadora del oxígeno en la sangre, funciones estructurales como el colágeno (pelos, uñas).
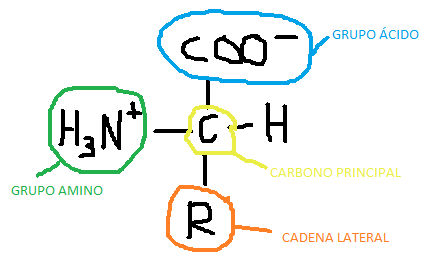
Existen 20 aminoácidos que pueden conformar las proteínas. Los aminoácidos están formados por un grupo amino, un grupo ácido, un carbono principal y la cadena R, que variará en función del aminoácido. Dentro de los aminoácidos podemos clasificarlos en Aas esenciales y no esenciales. Los esenciales, serán aquellos que el cuerpo no puede sintetizarlos por el mismo y necesitará de un aporte externo y, los no esenciales, serán aquellos que el cuerpo a través de diferentes procesos metabólicos puede sintetizarlos.
Nuestro organismo contiene en torno a 6-10 kg de proteínas y a diferencia de los hidratos de carbono y las grasas, las proteínas no tienen un sistema de depósito lo que supone que una pérdida de las mismas nos va a llevar a un deterioro de las funciones si no las proporcionamos proteínas extra a través de la dieta. Perder entre un 30-40% de nuestras proteínas corporales nos conduce a la muerte.
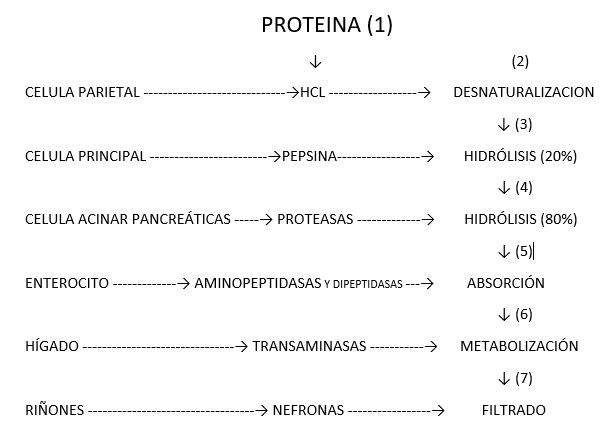
(1) DESNATURALIZACIÓN DE PROTEÍNAS.
A través de la dieta, las personas consumen diferentes alimentos ricos en proteínas como la carne, la leche, los huevos y el pescado. Una vez ingeridos los alimentos llegan al estómago y allí comienza la desnaturalización de las proteínas por acción del HCL (ácido clorhídrico) producido por las células parietales del estómago. Como ya hemos comentado, las proteínas tienen una estructura tridimensional compleja.
La desnaturalización consiste en la perdida de la estructura tridimensional terciaria que es la que dota de actividad biológica a la proteína para así transformarla en una estructura más simple. La desnaturalización de una proteína puede ocurrir también cuando la sometemos a una alta temperatura. Es fácil de observar con el huevo cuando hacemos una tortilla como cambia la clara de líquido viscoso transparente a sólido y blando. Este proceso es fundamental ya que nuestro intestino no puede absorber moléculas tan grandes por lo que el cuerpo debe realizar este primer paso y así, transformarlas cada vez en estructuras más simples.
El cuerpo humano es un organismo muy inteligente y sumamente sincronizado. Cuando olemos, tocamos o saboreamos un alimento, se produce una respuesta, a través de las células parietales situadas en el estómago que comienzan a secretar HCL.
Tenemos 3 FASES de secreción gástrica de HCL: Cefálica, Gástrica e Intestinal
- Fase Cefálica: Supone un 30% de la secreción total de HCL. Cuando olemos, tocamos o saboreamos un alimento, nuestro organismo a través del SNC (sistema nervioso central), manda una señal a los nervios vagos que usan un neurotransmisor fundamental, la acetilcolina (Ach) encargado de estimular la célula parietal en su función de producir HCL.
- Fase Gástrica: Supone el 60% de la secreción total de HCL. Al entrar los alimentos en el estómago éste se distiende activándose los reflejos del SNC y Reflejos vagales, la Ach entonces manda la señal a la célula parietal encargada de la secreción de HCL. Esta es la fase que aporta mayor producción de HCL.
- Fase Intestinal: Supone únicamente el 10%. La comida del estómago pasa al intestino delgado a través del duodeno y allí el quimo duodenal ácido digiere aquellas proteínas que no se han descompuesto demasiado.
(2) HIDRÓLISIS DE PROTEÍNAS POR ACCIÓN DE LA PEPSINA.
En el mismo estómago el HCL encargado de la desnaturalización de las proteínas activa la producción la producción de pepsinógeno a través de la célula principal al detectar un PH ácido ya que es cuando mejor actúa (PH 1,8-3). El pepsinógeno es una proenzima sin actividad biológica, necesita activarse en enzima para poder realizar su función de hidrólisis de proteínas. Aquí es donde entra el HCL, que transforma el inactivo pepsinógeno en su forma activa: pepsina. La pepsina es una enzima digestiva de la familia de las proteasas que se encarga de hidrolizar las proteínas en el estómago. La hidrólisis de proteínas consiste en romper los enlaces peptídicos entre aminoácidos por acción del agua. Recordemos que una proteína esta formada por un conjunto de aminoácidos unidos por enlaces peptídicos. Esta proteasa utiliza H2O para romper los enlaces péptidos de la proteína. La pepsina hidroliza un 20% del total de las proteínas que ingerimos. La pepsina rompe las uniones peptídicas de fenilalanina y tirosina
(3) HIDRÓLISIS DE PROTEÍNAS POR ACCIÓN DE LAS ENZIMAS PANCREÁTICAS.
Después de varias horas de digestión en el estómago se forma el quimo, una masa ácida donde las proteínas ingeridas se han transformado en elementos más pequeños, que a través de los movimientos peristálticos del estómago van a pasar hacia el intestino de forma regular. El mismo intestino va a ser el encargado de estimular al páncreas en la secreción de enzimas proteolíticas terminando así la degradación total de las proteínas.
Recordemos que el quimo al ser una mezcla de alimentos, HCL y proteasas posee un PH ácido que puede dañar al duodeno si no lo neutraliza. Aquí es donde el páncreas va a realizar dos funciones muy importantes:
- Secretar enzimas proteolíticas para terminar con la degradación total de proteínas. El estómago solo hidroliza un 20% y es aquí, a través del jugo pancreático donde se va a producir el otro 80% de hidrólisis proteica.
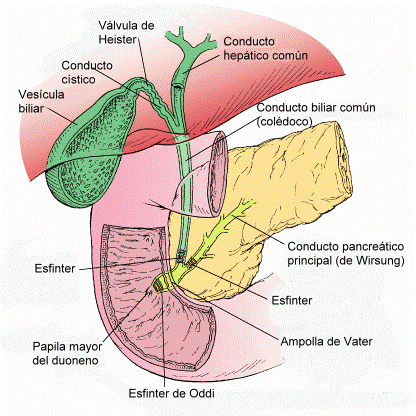
- Segregar iones HCO3- que neutralicen el quimo ácido evitando así una posible úlcera duodenal. Como vemos en la foto de la derecha, el duodeno está comunicado a con el páncreas y la vesícula biliar a través del conducto de Wirsung y colédoco que desembocan en el esfínter de Oddi.
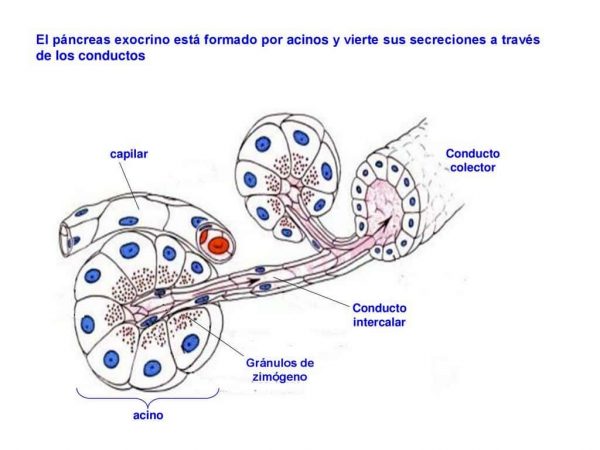
Como hemos hablado anteriormente el páncreas secreta el jugo pancreático a través de las células acinares que vemos en la imagen y HCO3- a través del conducto pancreático para neutralizar el PH ácido el quimo procedente del estómago. La secretina es la hormona que regula la secreción de HCO3- por parte de las células de los conductos pancreáticos en respuesta a un PH de quimo inferior a 4,5.
Dentro de las enzimas proteolíticas secretadas por el páncreas nos encontramos con sus formas inactivas: Tripsinógeno, Quimiotripsinógeno, Procarboxipolipeptidasa. Es muy importante destacar que la activación de la tripsina se produce una vez está en la luz del intestino de lo contrario, supondría una auto digestión del páncreas dando lugar a una pancreatitis. Para ello, la célula acinar pancreática, además de segregar tripsinógeno segrega un inhibidor de la tripsina para evitar que se produzca una activación en cualquier sitio que no sea la luz del intestino.
- El tripsinógeno es activado a tripsina en el duodeno por medio de la enteroquinasa, una enzima producida por el enterocito que convierte el tripsinógeno inactivo en tripsina. La tripsina funciona como activador enzimático creando una cascada enzimática pancreática.
- La tripsina ya activa en el duodeno actúa como catalizador en cascada trasformando en enzimas activas al Quimiotripsinógeno que pasa a ser quimiotripsina y la carboxipolipeptidasa que pasa a ser
La tripsina, quimiotripsina y carboxipeptidasa se van a encargar del hidrolizar el 80% restante ya que recordemos, en el estómago solo se produce alrededor de un 20% de hidrólisis de las proteínas. Ahora ya tenemos las proteínas digeridas en Aas simples, dipéptidos y tripéptidos, moléculas de mucho menor tamaño que ahora si van a poder ser absorbidas por el enterocito.
Al igual que en el estómago, tenemos 3 FASES de secreción pancreática:
- Cefálica: A través del tacto, olor, visión o gusto el SNC manda una señal a través del neurotransmisor Ach (acetilcolina) que activa la célula acinar pancreática en la secreción de enzimas (tripsina, quimiotripsina, carboxipeptidasa). Esta secreción supone un 20% del total.
- Gástrica: Con la llegada de los alimentos al estómago se produce una secreción del 5-10% del total, es la fase de menor secreción.
- Intestinal: Finalmente, cuando el quimo llega al duodeno estimula a las células S y Células I debido a un PH<4,5. Estas células S segregan secretina y las I Colecistoquinina (CCK) que van a promover la secreción pancreática de HCO3- y proteasas, para neutralizar el quimo ácido y terminal la degradación de proteínas. Esto supone el 80% de la secreción total y es la fase de mayor secreción.
Llegados a este punto nos encontramos las proteínas digeridas en di y tripéptidos y aminoácidos libres que ahora si van a ser lo suficientemente pequeñas como para pasar a través de las membranas de las células del intestino (enterocito).
(4) ABSORCIÓN DE AMINOÁCIDOS DIPEPTIDOS Y TRIPEPTIDOS.
Como podemos ver en la imagen debido a la accion gástrica, peptidasas y enzimas pancreaticas, la proteína ha quedado reducida a Oligopeptidos (di y tripeptidos) y Aminoacidos. El encargado de realizar la absorcion ahora será el intestino delgado a traves de los diferentes transportadores celulares situados en el enterocito. El intestino es capaz de absorber tanto aminoácidos libres como di y tripeptidos hacia el interior aunque para hacernos una idea el 90% de la absrocion corresponde a aminoacidos en forma libre y solo el 10% a di y tripeptidos. Se trata de algo lógico ya que son partículas de mayor tamaño con lo cual es m´ss complicado introducirlas en el interior del enterocito. Los peptidos son transportados hacia el interior del enterocito en cotransporte con el H+ por vía de PEPT1 ( proteína que actua como transportadora hacia el interior del enterocito de di y tripeptidos de ahí sus nombre PEPT (peptide).
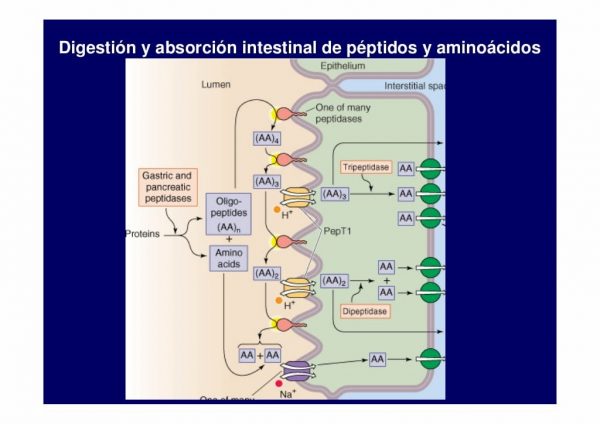
Recordemos que esto solo es el 10% de la absorcion, el 90% de la absorcion proviene de aminoácidos y son cotrasnportados con el NA+ de ahí la importancia del aporte de sodio atraves de la dieta porque una deficiencia va a causar una disminución en la absorcion de Aas al ser sodio-dependientes. No entraremos en detalle pero hay numeros transportadores membranales de aminoácidos y aunque la mayoría son sodio-dependientes tambien podemos encontrar transporte facilitado. El tranporte facilitado es sencillo de entender, cuando se hacen cotransportes de AAs con iones, estamos entroduciento en el interior de la célula iones con una carga positiva o negativa que va a generar un gradiente electroquímico y como la naturaleza es inteligente y trata de mantener siempre un sistema estable en equilibrio, va a tratar de compensar este gradiente absorviendo ciertos compuestos hasta equilibrarse. De esta manera el gradiente facilita la entrada de Aas hacia el interior del enterocito sin necesidad del cootransporte con el sodio. El termino activo o pasivo hace referencia a si hace falta o no energía para mover ese aminóacido desde fuera hasta el interior de la célula. Un transporte activo significará que el sistema tiene un gradiente 0, está en equilibrio con lo cual para alterarlo necesitamos aportar energía y esta energía va a ser ATP usado por las proteínas transportadores o bombas de iones para poder mover iones y AAs de un lugar a otro. En cambio, cuando el sistema no esta en equilibrio y hay un gradiente, todo tiende a equilibrarse con lo cual no hace falta aporte de energía ya que la celula va a hacer por captar iones hasta equilibrar la carga. Polos o cargas opuestos se atraen.
El mismo enterocito en su interior tiene peptidasas (dipeptidasas y tripeptidasas) que van a degradar esos di y tripeptidos absorbidos intactos por via PEPT1 en aminoacidos libres y posteriormente van a pasar al torrente sanguíneo. Los aminoácidos ramificados a diferencia del resto van a ser enviados directos al musculo, el resto irán al hígado para metabolizarse.
Como norma general, al torrente sanguíneo solo pasan aminoácidos libres aunque en la práctica, nos encontramos con diferentes alergias que son debidas a que compuestos más grandes consiguen “superar” la barrera dando lugar a una respuesta inmunológica. En el caso de la enfermedad celíaca ocurre justamente esto, debido a una problema en la mucosa intestinal algunas moléculas mas grandes (peptidos) “se cuelan” ocasionando una intolerancia a dicha proteína.
(5) DESTINO DE LOS AMINOÁCIDOS Y METABOLISMO EN EL HÍGADO.
Ahora nos encontramos con que los aminoácidos ya están en el torrente sanguíneo y se juntan con otros aminoácidos provenientes de la degradación de proteínas endógenas. Recordemos que nuestras células están en continua renovación y degradación por eso es importante mantener un balance de nitrógeno positivo, de lo contrario el cuerpo estará destruyendo más tejido del que puede regenerar dando lugar a procesos de desnutrición. Por eso es importante un buen aporte proteico. Los aminoácidos provenientes de la dieta se juntan en sangre con los de la degradación proteica endógena y aquellos otros que son producidos en el hígado. Volviendo un paso atrás recordemos que hay aminoácidos esenciales y no esenciales, estos primeros no pueden ser sintetizados por el organismo de modo que necesitamos aportarlos a través de ingesta proteica, en cambio, los segundos se pueden producir a partir de otros aminoácidos en el hígado mediante el proceso de transaminación que comentaremos a continuación.
Estas tres fuentes de aminoácidos generan un fondo común llamado “pool de aminoácidos” que van ser utilizados para los diferentes procesos: Síntesis de Proteínas, síntesis de compuestos no proteicos, desaminación y excreción.
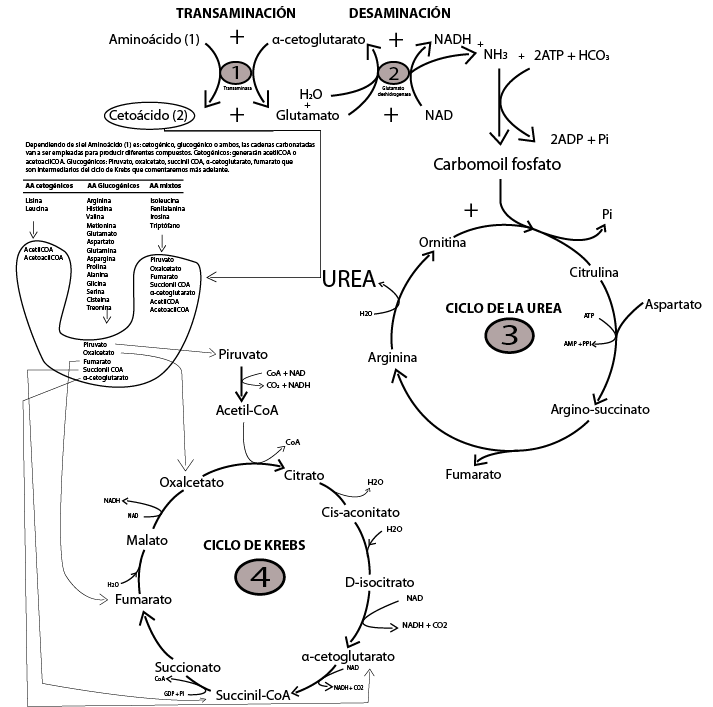
La transaminación es un proceso metabólico producido en el hígado donde a partir de un AA1 (aminoácido 1) y un Cetoácido se obtiene un AA2(aminoácido 2) y cetoácido. Estas reacciones son catalizadas por las enzimas hepáticas entre las cuales destacan por su importancia la ALT (alanina transferasa) y AST (aspartato transferasa).
aminoácido (1) + α-cetoácido (1) <==> α-cetoácido (2) + Glutamato
La Desaminación: Una vez se ha realizado el proceso de transaminación como veíamos anteriormente tenemos glutamato. El grupo amino de este aminoácido puede ser ahora separado por un proceso conocido como desaminación oxidativa. Glutamato + H20 + NAD ——–> α-cetoglutarato + NH3 +NADH, toda esta reacción es catalizada por la enzima Glutamato hidrogenasa.
Como vemos en este proceso de desaminación se produce α-cetoglutarato y además NH3 (amoniaco), una sustancia sumamente toxica para nuestro organismo. El NH3 va a degradarse a urea a través del ciclo de la urea, una sustancia menos toxica que si puede viajar a través de la sangre para finalmente se excretada por los riñones.
El α-cetoglutarato producido en la desaminación va a introducirse en el ciclo de Krebs, una de las rutas metabólicas más importantes encargadas en la respiración celular. Se obtiene energía oxidando Acetil Coa en forma de ATP.
Síntesis de proteínas: El organismo y sus células están en continua renovación para que esta renovación se produzca, se necesitan sintetizar nuevas proteínas que recordemos, son cadenas polipeptídicas (varios aminoácidos), de tal manera que estos aminoácidos que circulan por el torrente sanguíneo (no hay reservas o lugares de almacenamiento para aminoácidos) se unirán a dichas cadenas en su labor de creación de nuevas proteínas funcionales.
Ahora que sabemos los diferentes usos de los AAs vamos a centrarnos en los procesos para los que los va a usar el cuerpo en función del estado en que se encuentre.
Estado 1: Cuando tenemos un exceso de AAs en sangre y energía se va a producir la síntesis de lípidos ya que el cuerpo tiene cubiertas todas las necesidades.
Estado 2: Tenemos exceso de AAs pero necesita energía el cuerpo. Se va a producir la fosforilación oxidativa de acetil Coa en el ciclo de Krebs para obtener CO2 y ATP (la energía que utilizan nuestras células).
Estado 3: Estado de ayuno, donde los AAs utilizados provienen del catabolismo de proteínas. Si tenemos AAs suficientes, el cuerpo los va a utilizar del Pool sanguíneo, pero si no hay suficiente aporte a través de la dieta, el cuerpo va a comenzar a degradar proteínas endógenas (catabolismo) para mantener las funciones. Las cadenas carbonatadas de los AAs van a ser destinadas para la Glucogénesis (síntesis de glucógeno) y cetogénesis (producción de cuerpos cetónicos).
En la foto de abajo podemos ver las diferentes rutas metabólicas y la interrelación entre las mismas. Dentro de los diferentes aminoácidos nos encontramos con AAs cetogénicos, glucogénicos y mixtos. Esto hará referencia a que tipos de cuerpos van a ir destinadas sus cadenas carbonatadas.
AAs Cetogénicos: Lisina y Leucina → Acetil CoA y AcetoacilCoA.
AAs Glucogénicos: Arginina, histidina, valina, metionina, glutamato, aspartato, glutamina, aspargina, prolina → Fumarato, oxalcetato, piruvato y succionil CoA, α-cetoglutaratoalanina, glicina, serina, cisteína, treonina.
AAs mixtos: Isoleucina, fenilalanina, tirosina, triptófano → Acetil CoA, AcetoacilCoA, Fumarato, oxalcetato, piruvato, succionilCoA y α-cetoglutarato.