|
|
|
|
Propiedades químicas del galio
|
|
||||||||||||||||||||||||||
|
Elemento químico,
símbolo Ga, número atómico 31 y peso atómico 69.72. lo descubrió Lecoq de
Boisbaudran en Francia en 1875. Tiene un gran intervalo de temperatura en el
estado líquido, y se ha recomendado su uso en termómetros de alta temperatura
y manómetros. En aleación con plata y estañó, el galio suple en forma
adecuada la amalgama en curaciones dentales; también sirve para soldar
materiales no metálicos, incluyendo gemas o amtales. El arseniuro de galio
puede utilizarse en sistemas para transformar movimiento mecánico en impulsos
eléctricos. Los artículos sintéticos superconductores pueden prepararse por
la fabricación de matrices porosas de vanadio o tántalo impregnados con
hidruro de galio. El galio ha dado excelentes resultados como semiconductor para
uso en rectificadores, transistores, fotoconductores, fuentes de luz, diodos
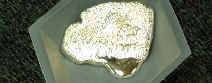
láser o máser y aparatos de refrigeración. El galio sólido parece gris azulado cuando
se expone a la atmósfera. El galio líquido es blanco plateado, con una
superficie reflejante brillante. Su punto de congelación es más bajo que el
de cualquier metal con excepción del mercurio (-39ºC o -38ºF) y el cesio
(28.5ºC u 83.3ºF). El galio es semejante químicamente al
aluminio. Es anfótero, pero poco más ácido que el aluminio. La valencia
normal del galio es 3+ y forma hidróxidos, óxidos y sales. El galio funde al
contacto con el aire cuando se calienta a 500ºC (930ºF). Reacciona
vigorosamente con agua hirviendo, pero ligeramente con agua a temperatura
ambiente. Las sales de galio son incoloras; se preparan de manera directa a
partir del metal, dado que la purificación de éste es más simple que la de
sus sales. El galio forma aleaciones eutécticas de bajo
punto de fusión con varios metales, y compuestos intermetálicos con muchos
otros. Todo el aluminio contiene cantidades pequeñas de galio, como impureza
inofensiva, pero la penetración intergranular de grandes cantidades a 30ºC
causa fallas catastróficas. Efectos
del galio sobre la salud El galio es
un elemento que se encuentra en el cuerpo, pero en cantidades muy pequeñas.
Por ejemplo, en una persona con una masa de 70 kilos, hay 0,7 miligramos de
galio en su cuerpo. Si esta cantidad de galio estuviera condensada en un
cubo, el cubo solo mediría 0,49 milímetros de lado. No tiene beneficios
provados en las funciones corporales, y lo más probable es que solo esté
presente debido a las pequeñas cantidades en el ambiente natural, en el agua,
y en los residuos en los vegetales o frutas. Se sabe que algunas vitaminas y
aguas de distribución comercial contienen cantidades traza de galio de menos
de una parte por millón. El galio puro no es una sustancia peligrosa por
contacto para los humanos. Ha sido manipulada muchas veces solo por el simple
placer de observar como se derrite por el calor emitido por una mano humana.
Sin embargo, deja manchas en las manos. Incluso el componente radioactivo del
galio, citrato de galio (67Ga), puede ser inyectado en el cuerpo y usado para
escáneres con galio sin efectos perjudiciales. Aunque no es peligroso en
pequeñas cantidades, el galio no debe ser consumido a propósito en grandes
dosis. Algunos compuestos del galio pueden ser de hecho muy peligrosos, sin
embargo. Por ejemplo, altas exposiciones al cloruro de galio (III) pueden
causar irritación de la garganta, dificultades de respiración, dolores
pectorales, y sus vapores pueden provocar afecciones muy graves como edema
pulmonar y parálisis parcial. Efectos ambientales
del galio Una controversia con
el galio involucra las armas nucleares y la polución. El galio es usado para
unir las minas entre sí. Sin embargo, cuando las minas se cortan y se forma
polvo de óxido de plutonio, el galio permanece en el plutonio. El plutonio se
ve inutilizado para su uso como combustible porque el galio es corrosivo para
varios otros elementos. Si el galio es eliminado, sin embargo, el
plutonio se vuelve útil de nuevo. El problema es que el proceso para eliminar
el galio contribuye a una gran cantidad de polución en el agua con sustancias
radiactivas. El galio es un elemento ideal para ser usado en minas, pero la
polución es destructiva para La Tierra y para la salud de sus habitantes.
Incluso haciéndose esfuerzos para eliminar la polución del agua, esto
incrementaría significativamente los costes de procedimiento de la conversión
de plutonio en un combustible (en alrededor de 200 millones de dólares). Los
científicos están trabajando en otro método para limpiar el plutonio, pero
pueden pasar años hasta que sea completado. Volver
a la tabla periódica. |
|||||||||||||||||||||||||||