|
|
||||
|
Proporcionan nutrientes vitales para que se desarrollen los procesos metabólicos en ellos y se consideran limentos para muchos, porque aportan los nutrientes básicos para que se sinteticen órganos de soporte, de transporte, de defensa entre otros, por ser la fuente única de nitrógeno en el organismo.Fuera de nutrir, cumplen un papel preponderante en la industria de alimentos, la que, se potencian todas las propiedades funcionales que presentan porque colaboran en el diseño, innovación, formulación y reformulación, entre otros de los productos alimenticios.
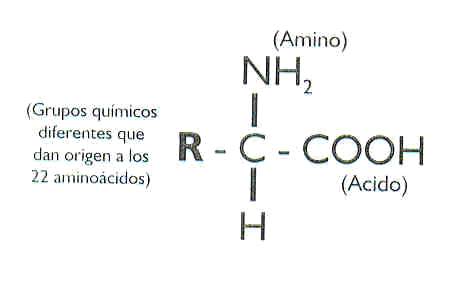
Como su nombre lo indica poseen en su
estructura un grupo carboxílo y uno amino, en posición L en el carbono
a (segundo carbono), dicho carbono es asimétrico por lo que genera dos
isómeros configuracionales, a excepción de la L-glicina, que no
presenta isomería óptica debido a que su grupo R, es un hidrógeno (R:
sustituyente alifático o aromático) . La forma de nombrar los 20 a.a, es utilizando
las tres o cuatro primeras letras, con el fin de facilitar la secuencia de la
proteína, así:
Glicina (gly), alanina (ala), valina (val), leucina (leu), isoleucina (ileu)
prolina (pro) serina (ser), serina (ser),
cisteina (cis), cistina (cys), metionina (met)
triptófano(trip),
fenilalanina(phe), tirosina(tir)
asparagina(asp-NH2), glutamina(glu-NH2)
lisina (lis), histidina (his), arginina(arg)
ácido aspártico(asp), ácido glutámico(glu) Los aminoácidos constituyentes de las
proteínas, también se pueden clasificar con base a la polaridad que presente
su grupo R, así:
Ácido glutámico, ác. Aspártico, gly, his, ser, lis, ser, tir, treo, cis,
glu-NH2, asp, arg.
ala, phe, leu, ileo, pro, trip, val, met Debido al comportamiento anfotérico presentado por los a.as , tanto su grupo amino como ácido pueden estar cargado a un pH determinado, cuando la suma de las cargas son iguales a cero, dicho pH se conoce como pI, si éste valor es alterado entonces el a.a, tendrá el siguiente comportamiento: pH>pka, prima NH3 Cada uno de los 20 a.as, poseen un valor único de pI, por lo tanto no es posible hacer aproximaciones, porque esto equivaldría decir que hay dos a.as iguales, lo que en la realidad no exiten, esto valores pueden ser muy parecidos pero no iguales. Para hacer el cálculo del pI, se tiene en cuenta los pkas, tanto del amino como del grupo ácido, se hace la suma y se promedia, arrojando el valor que indica el pI pI=pka1 +
pka2/2 Cuando el a.a posee un grupo amino o ácido adicional, el pI, se calcula con el pka3 o conocido también como e (epsilon) y el comportamiento será de acuerdo al pH al cual se encuentre el a.a. Los a.as se van asociando através de enlaces peptídicos, es decir que se une el grupo ácido de un aminoácido con el grupo amino del otro aminoácido, en esta forma van creciendo las cadenas y las combinaciones hasta formar las macromoléculas llamadas proteínas. El aminoácido del extremo izquierdo queda con
su grupo NH2 libre y se conoce como N-terminal y el amino ácido que queda en
el extremo derecho se conocen como C-terminal. Una de las propiedades de los a.a es la que no
absorben luz visible.Los a.as aromáticos absorben luz U.V a una longitud de
onda l= 280nm. Una de las pruebas que se realizan a nivel del laboratorio
para determinar a.as, es con la ninhidrina que al descarboxilar por una
reacción de oxidación los alfa a.as (CO2, NH3), generan un aldehido con
un
|
||||
|
|