|
|
|
FUNCIÓN
Necesaria para el desarrollo de los huesos, para mantener las células de las mucosas y de la piel y, en general, para el funcionamiento de todos los tejidos, previniendo infecciones respiratorias. El retinol ayuda a mejorar la visión nocturna, por su capacidad en convertirse en retinal (de ahí su nombre), suministrando moléculas para el proceso de la visión. Ayuda, por tanto, en muchos desórdenes de los ojos. El beta-caroteno (también llamado Pro-vitamina A), es uno de los principales antioxidantes que se encuentran en la naturaleza, un elemento esencial en la lucha contra los radicales libres y por lo tanto en la prevención de ciertas enfermedades, tales como el cáncer. DEFICIENCIA Incrementa la probabilidad de sufrir dolencias en las articulaciones ya que dificulta la regeneración de los huesos; ceguera crepuscular (mal llamada ceguera nocturna); disminución de la agudeza visual cuando oscurece; sensibilidad a infecciones como el sarampión y sequedad de la conjuntiva ocular, entre otros. TEN EN
CUENTA QUE La ingestión
de esta vitamina ha de ir acompañada de una adecuada dieta proteínica, de
otra forma se dificultaría su transporte en sangre y metabolismo. La vitamina
A es destruida fácilmente por factores tales como la contaminación ambiental.
Queda protegida de esta rápida destrucción cuando es ingerida junto a
alimentos ricos en vitamina E. Las intoxicaciones derivada de la ingestión de
una dosis alta de origen alimentario son excepcionales. Por un consumo
inadecuado de suplementos vitamínicos: descamación de la piel, dolor
abdominal y vómitos. Los síntomas desaparecen al dejar de tomarlas. FUENTES
ALIMENTARIAS Retinol:
hígado, pescado graso, yema de huevo, mantequilla y queso. Beta caroteno: albaricoque,
melón, zanahoria, mango, melocotón, espinacas, coles de Bruselas, tomate. La vitamina A sólo está presente como tal
en los alimentos de origen animal, aunque en los vegetales se encuentra
como provitamina A, en forma de carotenos. Los diferentes carotenos
se transforman en vitamina A en el cuerpo humano. Se almacena en el
hígado en grandes cantidades y también en el tejido graso de la piel
(palmas de las manos y pies principalmente), por lo que podemos subsistir
largos períodos sin su aporte. Se destruye muy fácilmente con la luz,
con la temperatura elevada y con los utensilios de cocina de hierro
o cobre. La función principal de la vitamina A es
la protección de la piel y su intervención en el proceso de visión
de la retina. También participa en la elaboración de enzimas en el
hígado y de hormonas sexuales y suprarrenales. El déficit de vitamina
A produce ceguera nocturna, sequedad en los ojos (membrana conjuntiva)
y en la piel y afecciones diversas de las mucosas. En cambio, el exceso
de esta vitamina produce trastornos, como alteraciones óseas, o incluso
inflamaciones y hemorragias en diversos tejidos. El consumo de alimentos
ricos en vitamina A es recomendable en personas propensas a padecer
infecciones respiratorias (gripes, faringitis o bronquitis), problemas
oculares (fotofobia, sequedad o ceguera nocturna) o con la piel seca
y escamosa (acné incluido). Su función principal consiste en la
protección del tejido epitelial, en la intervención de los mecanismos que
permiten el crecimiento y la reproducción y en el ciclo bioquímico de la
retina (formación del pigmento rodopsina). . Aun cuando esta vitamina debe obtenerse
a partir del ambiente, casi todas sus acciones, al igual que las de
la vitamina D, se ejercen por medio de receptores parecidos a hormona.
La vitamina A tiene diversos efectos en la regulación y diferenciación
celulares, que van mucho más allá de su función clásicamente definida
en la visión. Los análogos de la vitamina A, debido a sus acciones
notorias sobre la diferenciación epitelial, han encontrado importantes
aplicaciones terapéuticas en el tratamiento de diversos padecimientos
dermatológicos, y se están valorando en la quimioprofilaxia contra
el cáncer. Si bien el término vitamina A se ha usado
para denotar compuestos químicos específicos, como el retinoil o sus
ésteres, en la actualidad este término se utiliza más como un nombre
descriptivo genérico para compuestos que muestran las propiedades
biológicas del retinol. Retinoide se refiere a la sustancia química
retinol u otros derivados estrechamente relacionados que ocurren de
manera natural. Los retinoides también incluyen análogos sintéticos
que muestran relación estructural, que no necesariamente tienen actividad
parecida a la del retinol (vitamina A). La observación simple efectuada por Steenbock
(1919), de que el contenido de vitamina A de vegetales varía con el
grado de pigmentación, preparó el camino para el aislamiento de la
vitamina y el descubrimiento de la naturaleza química de la misma.
Después, se demostró que el pigmento vegetal purificado caroteno (provitamina
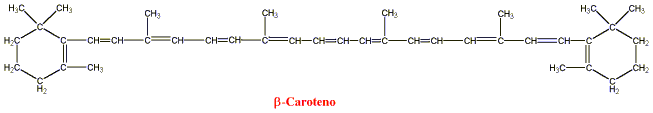
A) es una fuente muy potente de vitamina A. El b-caroteno, el carotenoide
más activo encontrado en vegetales, tiene la fórmula estructural que
se muestra.
Figura 12: Beta-caroteno. Tomado de Goodman y
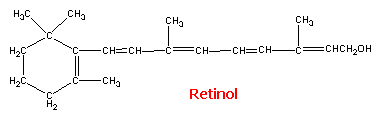
Gilman. Las bases farmacológicas de la terapéutica. El retinol (vitamina A1), un
alcohol primario, existe en forma esterificada en los tejidos de animales y
pescados de agua salada, principalmente en el hígado. Su fórmula estructural es como sigue:
Figura 13: Retinol. Tomado de
Goodman y Gilman. Las bases farmacológicas de la terapéutica. Un compuesto estrechamente relacionado,
el 3-deshidrorretinol (vitamina A2), se obtiene a partir de los
tejidos de pescados de agua dulce, y por lo general se encuentra mezclado con
el retinol. Hay diversos isómeros geométricos del retinol
debido a las posibles configuraciones cis-trans alrededor de los dobles
enlaces en la cadena lateral. Los aceites de hígado de pescado contienen
mezclas de estereoisómeros; el retinol sintético es el isómero holo-trans.
En el organismo ocurre con facilidad interconversión entre isómeros.
En el ciclo visual, la reacción entre retinal (aldehído de vitamina
A y opsina, para formar rodopsina, sólo tiene lugar con el isómero
11-cis. Los éteres y ésteres derivados del
alcohol también muestran actividad in vivo. La estructura en anillo del
retinol (b-ionona), o el anillo más insaturado en el 3-deshidrorretinol
(deshidro-b-ionona), es esencial para la actividad; la hidrogenación destruye
la actividad biológica. De todos los derivados conocidos, el
holo-trans-retinol y su aldehído, retinal, muestran la mayor potencia
biológica in vivo. El ácido retinoico vitamina A ácida), en
la cual el grupo alcohol se ha oxidado, comparte algunos de los efectos
del retinol. El ácido retinoico es ineficaz para restituir la función
visual o reproductora en ciertas especies en las cuales el retinol
es útil. Con todo, el ácido retinoico tiene mucha potencia para favorecer
el crecimiento y controlar la diferenciación del tejido epitelial
y la conservación del mismo en animales con deficiencia de vitamina
A. De hecho, el ácido holo-trans-retinoico (retionina) parece ser
la forma activa de la vitamina A en todos los tejidos salvo en la
retina, y es 10 a 100 veces más potente que el retinol en diversos
sistemas in vitro. La isomerización de este compuestos en el organismo
proporciona ácido 13-cis-retinoico (isotretinoína), que es casi tan
potente como la tretinoína en muchas de sus acciones sobre tejidos
epiteliales, pero puede ser hasta cinco veces menos potente en la
producción de los síntomas tóxicos de la hipervitaminosis A. Se han sintetizado muchos análogos del
ácido retinoico, entre ellos el profármaco etretinato, que es el etil
éster del compuesto activo acitretina. Esos compuestos son representativos
de la llamada segunda generación de retinoides, en la cual el anillo
b-ionona está aromatizado; tales compuestos son más activos que la
tretinoína en algunos sistemas, pero menos activos en otros. Los retinoides
potentes de \"tercera generación\" muestran dos anillos
aromáticos que sirven para restringir la flexibilidad de la cadena
lateral polienoica. Esta clase de retinoides aromáticos se ha denominado
arotinoides, que incluyen el ácido Ro 13-7410, y la etil sulfona,
Ro 15-1570. La vitamina A tiene varias funciones
importantes en el organismo. Es esencial en la función de la retina. Es
necesaria para el crecimiento y la diferenciación del tejido epitelial, y se
requiere en el crecimiento del hueso, la reproducción y el desarrollo
embrionario. Junto con algunos , la vitamina A
aumenta la función inmunitaria, reduce las consecuencias de algunas
enfermedades infecciosas y puede proteger contra la aparición de ciertas
enfermedades malignas. Como resultado, hay considerable interés por el uso
farmacológico de retinoides para la profilaxia del cáncer, y para tratar
diversos padecimientos premalignos. Debido a las acciones de la vitamina A
sobre tejidos epiteliales, los retinoides y sus análogos se utilizan para
tratar diversas enfermedades cutáneas, entre ellas algunas de las
consecuencias del envejecimiento y de la exposición prolongada a la luz
solar. Las funciones de la Vitamina A están mediadas
por diferentes formas de la molécula. En la visión, la vitamina funcional
es el retinal. El ácido retinoico parece ser la forma activa en funciones
relacionadas con el crecimiento, la diferenciación y la transformación.
Figura 14: Síntesis de la
rodopsina. Tomado de Goodman y Gilman. Las bases farmacológicas de la
terapéutica. Mecanismo de acción En fibroblastos o tejido epitelial aislados,
los retinoides aumentan la síntesis de algunas proteínas (p. ej.,
fibronectina), y reducen la de otras (p. ej., colagenasa, ciertas especies de
queratina), y pruebas moleculares sugieren que esos efectos pueden expli completamente por los
cambios de la transcripción nuclear (Mangelsdord y cols., 1994). El ácido
retinoico parece ser mucho más potente que el retinol para mediar esas
acciones. El ácido retinoico influye sobre la expresión
de genes al combinarse con receptores nucleares. Se han descrito múltiples
genes que codifican para receptores de ácido retinoico. Tres de esos,
designados a, b y g, se han localizado en los cromosomas humanos 17,
3 y 12, respectivamente. Muestran extensa homología de secuencia entre
sí tanto en su ADN como en dominios de unión a hormona, y pertenecen
a una superfamilia de receptores que incluye receptores para esteroides
y hormonas esteroides, así como calcitriol. A últimas fechas se ha
agregada a esta superfamilia otro grupo de receptores designado RXR.
Las respuestas celulares a hormonas tiroideas y esteroides, calcitriol
y ácido retinoico aumentan por la presencia de extractos nucleares
que contienen RXR. Los genes regulados por esas hormonas poseen elementos
de reacción específicos para hormona en sitios promotores torrente
arriba. La activación de genes comprende unión del complejo de hormona-receptor,
seguida por dimerización con complejo RXR-ligando. A últimas fechas,
se ha demostrado que la identidad del ligando RXR endógeno es el ácido
9-cis-retinoico. Hasta la fecha, no se ha detectado un receptor comparable
para retinol, y es posible que este último tenga que oxidarse hacia
ácido retinoico para producir sus efectos dentro de células blanco.
Los retinoides tal vez influyan sobre la
expresión de receptores para ciertas hormonas y factores del crecimiento; de
este modo, afectarían el crecimiento, la diferenciación y la función de
células blanco mediante acciones tanto directas como indirectas. Dado que la vitamina A regula la diferenciación
de células epiteliales y la proliferación de las misma, la capacidad
aparente del retinol y compuestos relacionados para interferir con
la carcinogénesis ha despertado considerable interés. La deficiencia
de vitamina A en seres humanos aumenta la sensibilidad a la carcinogénesis;
las células basales de diversos epitelios sufren hiperplasia notoria
y diferenciación celular reducida. La administración de retinol u
otros retinoides en animales revierte esos cambios en el epitelio
de vías respiratorias, glándulas mamarias, vejiga urinaria y piel.
De este modo, la progresión de células premalignas hacia células con
características invasoras, malignas, se torna lenta, retrasa, suspende
o incluso revierte en animales de experimentación. El efecto antitumoral
se observa en enfermedades malignas de origen tanto epitelial como
mesenquimatoso, inducidas por sustancia químicas y por virus, así
como en la transformación inducida por radiación o por factores del
crecimiento. La reversión del crecimiento de neoplasias establecidas,
y de metástasis de las mismas, in vivo, ha sido limitada, al igual
que la prevención del crecimiento de neoplasias que pueden trasplantarse
en animales. Todavía no está claro el mecanismo exacto
del efecto anticarcinógeno. La acción es observable incluso si el
retinoide se administra muchas semanas después de la exposición a
un carcinógeno, lo cual sugiere interferencia en la promoción de la
fase de carcinogénesis o la progresión de la misma. Un mecanismo posible
que puede contribuir al efecto antitumoral es la inducción de la diferenciación
en células malignas para formar células normales maduras desde el
punto de vista morfológico. Por ejemplo, los retinoides regulan la
síntesis de proteínas específicas (p. ej., queratina) necesarias para
la diferenciación de tejidos epiteliales. Además, la vitamina A parece
tener una función bioquímica específica en la síntesis de glucoproteínas
y glucolípidos de superficie celular que pueden participar en la adherencia
de células y la comunicación entre estas últimas. La conversión de
retinol en fosfato de retinil en células epiteliales va seguida por
formación de manosil retinil fosfato en los microsomas, un derivado
de retinol glucosilado que media la transferencia de manosa hacia
glucoproteínas de superficie celular específicas. La formación de
esas proteínas se reduce de manera aguda cuando hay deficiencia de
vitamina A. Las reacciones de este tipo pueden explicar la función
de la vitamina en diversos procesos que dependen de la integridad
de la superficie celular, y podrían contribuir a la supresión del
fenotipo maligno previamente inducido por un carcinógeno. También
pueden mejorar los mecanismos de defensa inmunitarios del huésped.
En cualquier caso, parece poco probable un efecto citotóxico directo.
Aún cuando muchos estudios
epidemiológicos han demostrado una relación inversa entre la ingestión de
vitamina A en la dieta y morbilidad y mortalidad por cáncer (en especial, cáncer
pulmonar), la correlación con la ingestión de retinol en sí ha sido poco
constante. Como resultado, en la actualidad se está enfocando la atención en
los efectos biológicos del b-caroteno y otros carotenoides no compartidos por
el retinol. Durante muchos años, se ha sabido que la
deficiencia de vitamina A se relaciona con incremento de la sensibilidad a
infecciones bacterianas, parasitarias y virales. Se ha demostrado decremento
de la resistencia a infecciones en muchos modelos de deficiencia de vitamina
A en animales, e incluso el estado marginal en cuanto a vitamina A aumenta la
gravedad de enfermedades infecciosas y la duración de las mismas. Aun cuando
en animales con deficiencia de vitamina A se han informado cambios del tamaño
de los tejidos linfáticos y la celularidad de los mismos, se ha observado
considerable incongruencia entre modelos de animales, así como con la
gravedad del agotamiento de vitamina A y la duración del mismo. Con respecto
a la inmunidad mediada por células, ante deficiencia de vitamina A, hay claro
deterioro de la proliferación de linfocitos en el bazo, que también se ha
relacionado con decremento de la actividad citotóxica de células asesinas. En
lo que se refiere a la inmunidad humoral, los resultados varían según sean los
antígenos específicos. Estudios en animales muestran de modo constante una
relación entre el estado en cuanto a vitamina A y la respuesta de anticuerpos
a toxoide tetánico. En algunos estudios, se ha detectado aumento de las
respuestas a la vacunación contra el tétanos en poblaciones de seres humanos
con nutrición marginal, mediante coadministración de vitamina A. Se ha
estudiado mucho el vínculo entre vitamina A, nutrición y sarampión. En
estudios clínicos grandes, el suministro de esta vitamina en niños con
sarampión dio por resultado gran reducción de la morbilidad y la mortalidad.
En consecuencia, en una publicación conjunta de OMS/UNICEF, se recomendó que
todos los niños con diagnóstico de sarampión en países donde la tasa de
letalidad es de 1% o más, deben recibir de inmediato 30 a 60 mg de vitamina
A, dependiendo de la edad. Los requerimientos de vitamina A en
seres humanos se han calculado a partir de estudios en los que se ha
intentado corregir estados de deficiencia producidos experimentalmente. Las
recomendaciones actuales del Food and Nutrition Board del National Research
Council se basan en la cantidad de retinoide necesaria para conservar
adaptación normal a la oscuridad, más un factor de seguridad adicional para
cubrir variaciones de la absorción de retinol y la utilización del mismo. Las
raciones diarias recomendadas para varones y mujeres adultos normales son de
1000 y 800 equivalentes de retinol al día, respectivamente suponiendo que el
50% de la vitamina A en la dieta se deriva del retinol, y el 50% del
b-caroteno. El adulto promedio occidental recibe
alrededor de 50% de la ingestión diaria de vitamina A como retinol o retinil
ésteres, y el resto como carotenoides. Las principales fuentes de vitamina A
en la dieta son hígado, mantequilla, queso, leche entera, yema de huevo y
pescado. El b-caroteno se encuentra en diversas frutas y vegetales amarillos
o verdes. Esos alimentos también contienen muchos carotenoides que no pueden
convertirse en retinol. Empero, muchos de ellos funcionan como antioxidantes
y es posible que tengan efectos útiles que favorecen la salud.
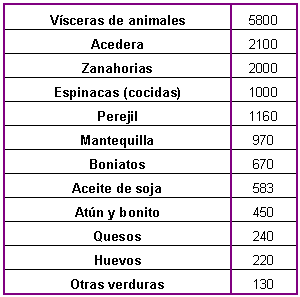
Tabla 5: Alimentos ricos en
vitamina A. Cantidad recomendada por día: 800-1000 ng. (cantidades expresadas
en ng/100 gr. Tomado de Goodman y Gilman. Las bases farmacológicas de la
terapéutica. Está presente en los alimentos animales
como leche, mantequilla, yema de huevo, hígado; en los vegetales se encuentra
como provitamina A, en forma de carotenos, transformándose en vitamina A en
el organismo, destacando; la zanahoria, espinaca, escarola, pimiento,
lechuga, cardo, tomate, perejil. Existen dos tipos de deficiencias:
primaria: por ingesta deficiente de alimentos ricos en ella; un hecho a tener
en cuenta es que se puede almacenar en grandes cantidades en el hígado y
podemos pasar grandes periodo sin consumirla antes de que se manifiesten
deficiencias. La deficiencia secundaria surge por cualquier causa que
interfiera en la absorción intestinal de las grasas o bien su almacenamiento
en el hígado. Los síntomas pueden llegar a ser graves,
como la ceguera nocturna y los problemas de cornea, ulceras, xerosis corneal,
o la membrana conjuntiva. También su deficiencia ocasiona lesiones de la piel
y mucosas, sequedad y atrofia de la epidermis. El exceso de esta vitamina, puede
producir trastornos como anorexia, o perdida de peso, nauseas, vómitos,
alteraciones óseas inflamaciones o hemorragias. Su consumo es recomendable en personas
con infecciones respiratorias, problemas oculares o piel seca y escamosa. Más del 90% del retinol en la dieta se
encuentra en forma de ésteres, por lo general retinil palmitato. Al igual que
con los triglicéridos, casi todos los retinil ésteres se hidrolizan en la luz
intestinal mediante las enzimas pancreáticas, y dentro del borde en cepillo
de las células epiteliales del intestino antes de la absorción. Si bien es
lipófilo, la captación del retinol por las células intestinales al parecer
ocurre por medio de un proceso mediado por acarreador y es facilitada por una
proteína citosólica que se une de manera específica al retinol con afinidad
alta. Esta proteína celular de unión a retinol (CRBP), que tiene estrecha
relación con la CRBP en muchas células de todo el organismo se denomina CRBP
II. Sólo se encuentra en las células de absorción en el intestino delgado,
donde constituye alrededor de 1% de la proteína soluble total. Casi todo el
retinol sufre reestirificación (principalmente hacia palmitato) dentro de
esas células, y se incorpora en kilomicrones; después de dosis grandes de
retinol por vía oral, también circulan cantidades importantes de retinil
ésteres en relación con lipoproteínas de baja densidad. Asimismo, se absorben
cantidades apreciables de retinol directamente hacia la circulación, donde
están unidas a la proteína de unión a retinol (RBP) en el plasma. Cuando se ingiere retinol en cantidades
que se aproximan a los requerimientos diarios, la absorción es completa; con
todo, parte de este compuesto escapa hacia las heces cuando se toman dosis
grandes. La concentración de retinol esterificado alcanza un máximo en el
plasma unas cuatro horas después de la ingestión de retinol. La absorción de
este último se reduce en anormalidades de la digestión de grasas y la absorción
de las mismas, como sucede en personas con enfermedad pancreática o hepática,
infecciones intestinales y fibrosis quística. En esos individuos han de
utilizarse preparaciones que se pueden mezclar con agua. Casi todos los retinil ésteres son captados
por el hígado por medio de internalización de remanentes de quilomicrón
mediada por receptor. Hasta que las reservas hepáticas de retinil ésteres
quedan saturadas, la administración de retinol conduce principalmente a su
acumulación en el hígado más que en la sangre. La mediana de la concentración
de retinil ésteres en el hígado de seres humanos es de unos 100 a 300 mg/g, y
el límite normal del retinol plasmático es de 30 a 70 mg/dl (1.1 a 2.4 mM).
Si un individuo ingiere una dieta sin retinol o sus precursores, las
concentraciones plasmáticas se conservan muchos meses a expensas de las
reservas hepáticas; éstas disminuyen con una vida media de alrededor de 50 a
100 días. Por ende, las cifras sanguíneas no constituyen una guía sensible
con respecto al estado de un individuo en cuanto a vitamina A, pero los
valores plasmáticos bajos indican posible agotamiento de las reservas
hepáticas de la vitamina. Los signos y síntomas de deficiencia de vitamina A
aparecen cuando la concentración plasmática disminuye por debajo de 10 a 20
mg/dl (0.35 a 0.70 mM), o cuando las cifras de retinoides en el hígado son
menores de 5 a 20 mg/g. en hepatopatía de origen alcohólico, hay depresión
grave de las concentraciones hepáticas de retinoides. Antes de entrar en la circulación desde
el hígado, los retinil ésteres hepáticos se hidrolizan, y de 90 a 95% del
retinol se relaciona con una a1-globulina, que tiene un sitio de
unión único para la vitamina. Esta proteína de unión a retinol se sintetiza
en el hígado y se secreta a partir del mismo, y después circula en la sangre
en complejos con transtiretina, una prealbúmina de unión a tiroxina;
asimismo, esta última estabiliza a dicha proteína de unión a retinol. La
formación de este complejo protege a la proteína de unión a retinol (y a este
último) circulantes contra el metabolismo y la excreción renal. En situaciones normales, más del 95% de
los retinoides plasmáticos está vinculado a proteína de unión a retinol.
Cuando las reservas hepáticas de la vitamina y el sistema acarreador de
proteína de unión a retinol quedan saturados debido a ingestión excesiva de
retinol o a daño hepático, hasta el 65% de los retinoides en plasma puede
hallarse como retinil ésteres relacionados con lipoproteína. De manera
similar, luego de administración intensiva de alcohol, se acumulan retinil
ésteres. Dado que el retinol es biológicamente inerte en tanto está unido a
la proteína de unión a retinol, esos retinil ésteres, que son tensoactivos,
generan gran parte de la toxicidad que se observa. El retinol unido a proteína de unión al
mismo, llega a la membrana celular de diversos órganos blanco, donde el
complejo se une a sitios específicos sobre la superficie celular. El retinol
se transfiere a una proteína de unión a membrana, que parece tener relación
estrecha con la proteína celular de unión a retinol soluble y se convierte en
un retinil éster. A continuación, una hidrolasa relacionada con la membrana
desdobla a este último, siempre y cuando haya proteína celular de unión a
retinol citosólica no unida a ligando, para aceptar el retinol. La proteína
celular de unión a retinol existe en casi todos los tejidos; las excepciones
comprenden músculo cardiaco y esquelético, así como la mucosa ileal, donde se
encuentra CRBP II estrechamente relacionada. Además de su participación en la
captación de retinol, la proteína celular de unión a retinol funciona como un
reservorio para el retinol celular y libera la vitamina hacia sitios
apropiados para su conversión en compuestos activos. En la retina, el retinol
se convierte en 11-cis-retinal, que se incorpora en la rodopsina; también hay
una proteína de unión específica (distinta de la proteína celular de unión a
retinol). En otros tejidos blanco, el retinol al parecer se oxida hacia ácido
retinoico, que es transportado hacia receptores en el núcleo, como un
complejo con la proteína celular de unión a ácido retinoico (CRABP). La
distribución de la CRABP en los tejidos parece ser casi idéntica a la de la
proteína celular de unión a retinol, con la posible excepción de que no se
encuentra en el hígado de adultos. La concentración plasmática de proteína
de unión a retinol es crucial para la regulación del retinol en el plasma y
su transporte hacia los tejidos. En la deficiencia de vitamina A, se conserva
la síntesis de proteína de unión a retinol, aumenta el contenido de esta
última en el hígado, y disminuye su concentración plasmática, al parecer
debido al bloqueo de la secreción de dicha proteína desde el hígado. Una vez
que queda disponible de nuevo el retinol, el hígado libera con rapidez
proteína de unión a retinol hacia el plasma para transporte de retinol hacia
los tejidos. Cuando hay deficiencia de proteína (p. ej., causada por
desnutrición, kwashiorkor, o hepatopatía parenquimatosa), la concentración de
proteína de unión a retinol se hace insuficiente, y las cifras plasmáticas de
retinol disminuyen a pesar de existir reservas normales en hígado. Se
requiere entonces rebastecimiento de calorías y proteínas. La deficiencia
tanto de proteína de unión a retinol como de este último no se puede corregir
mediante la administración de retinol solo. Otros estados patológicos también
alteran las concentraciones plasmáticas de retinol y proteína de unión al
mismo. En fibrosis quística, cirrosis relacionada con alcohol y enfermedades
hepáticas, se observa depresión de la síntesis de proteína de unión a retinol
en el hígado o de la liberación a partir de este último, y hay reducción de
las cifras plasmáticas de retinol. En proteinuria, infecciones febriles o
estrés, debe haber reducción drástica de la concentración sanguínea de
retinol, debido parcialmente a incremento de la excreción urinaria. Cuando
hay nefropatía crónica, se observan alteraciones del catabolismo de la
proteína de unión a retinol, y las cifras de la proteína y de retinol están
altas. Los estrógenos y los anticonceptivos
orales aumentan las concentraciones plasmáticas de proteína de unión a
retinol, pero las acciones en el embarazo son complejas. Durante el primer
trimestre, disminuye el contenido medio de retinol en plasma, seguido por un
incremento lento y regreso a lo normal en el momento del parto. Es probable
que las demandas aumentadas de retinol conduzcan a su supresión de la sangre
a una velocidad que excede la de su movilización desde el hígado. Las barreras
placentarias evitan la transferencia excesiva de retinol o carotenoides.
Estudios en animales sugieren que en etapas tempranas del embarazo ocurre
transporte transplacentario de proteína de unión a retinol; a partir de
entonces, el feto empieza a sintetizar su propia proteína de unión a retinol.
De este menor que en sangre materna. Tanto el calostro como la leche ofrecen
al recién nacido un aporte adecuado de retinol. El valor de retinol en la
leche se conserva a una cifra máxima fija si la ingestión materna de retinol
en la dieta es adecuada para permitir almacenamiento en el hígado. El retinol se conjuga en parte para
formar un b-glucurónido, que sufre circulación enterohepática y se oxida
hacia retinal y ácido retinoico. Zile y colaboradores (1982) propusieron una
posible participación fisiológica para retinil glucurónidos inducen
diferenciación celular en varias líneas de célula mediante mecanismos que aún
no están claros. No se unen a receptores de ácido retinoico. La actividad
indirecta de esos compuestos podría explicarse por hidrólisis intracelular
hacia ácido holo-trans-retinoico, o formación de proteínas retinoiladas
(Olson, 1993). Una propiedad recién descubierta de los retinoil glucurónidos
es su falta manifiesta de toxicidad en comparación con otros retinoides. Si
se confirma, esta característica ofrecería un importante avance para la
terapéutica con retinoide. Varios otros metabolitos hidrosolubles
también se excretan en la orina y las heces. En situaciones normales, es
imposible recuperar retinol sin cambios a partir de la orina de seres
humanos. Desde hace mucho se ha sabido que la
deficiencia de vitamina A interfiere en la visión en luz mortecina,
padecimiento conocido como ceguera nocturna (nictalopía). Las observaciones
fundamentales efectuadas por Hecht (1937), Hubbard y colaboradores (1965) y
Wald (1968) contribuyeron mucho a entender este fenómeno. La fotorrecepción se logra por medio de
dos tipos de células retinianas especializadas, llamadas bastones y conos.
Los bastones son en especial sensibles a la luz de baja intensidad; los conos
actúan como receptores de luz de alta intensidad, y de ellos depende la
visión del color. El paso inicial es la absorción de luz por un cromóforo
fijo a la proteína receptora. El cromóforo, tanto en bastones como en conos,
es el 11-cis-retinal. El holorreceptor en bastones se denomina rodopsina (una
combinación de la proteína opsina y 11-cis-retinal fijo a un grupo
prostético). Los tres tipos diferentes de células cono (rojo, verde y azul)
contienen proteínas fotorreceptoras relacionadas individuales y muestran
respuesta óptima a luz de diferentes longitudes de onda. En la síntesis de rodopsina, el
11-cis-retinol se convierte en 11-cis-retinal en una reacción reversible que
requiere nucleótidos piridina. A continuación, el 11-cis-retinal se combina
con el grupo e-amino de un residuo de lisina específico en la opsina para
formar rodopsina. La mayor parte de esta última se encuentra en las membranas
de los discos situados en los segmentos externos de los bastones. La cadena
polipeptídica de la proteína abarca siete veces la membrana, una
característica compartida por todos los receptores conocidos cuyas funciones
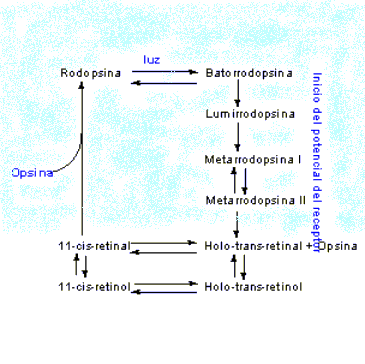
se transducen por medio de proteínas. El ciclo visual, descrito en la figura,
se inicia mediante la absorción de un fotón de luz, seguida por la
fotodescomposición, o blanqueamiento, de la rodopsina mediante una cascada de
estados de conformación inestables, que conduce finalmente a la isomerización
del 11-cis-retinal hacia la forma holo-trans, y disociación de la mitad de
opsina. La rodopsina activada interactúa con rapidez con otra proteína del
segmento externo del bastón retiniano, una proteína G llamada transducina o Gt.
La transducina estimula a una fosfodiesterasa específica para guanosin
3´,5´-monofosfato (GMP cíclico, GMPc). La declinación resultante de las
cifras de GMPc causa decremento de la conductancia de los canales del Na+
sensibles a GMPc en la membrana plasmática, y un potencial transmembrana aumentado.
Después de procesamiento dentro del sistema de circuitos retinianos, este
potencial de receptor primario conduce finalmente a la generación de
potenciales de acción que viajan hacia el cerebro mediante el nervio óptico. El holo-trans-retinal puede isomerizarse
de manera directa hacia 11-cis-retinal, que puede recombinarse entonces con
opsina para formar rodopsina. De manera alternativa, el holo-trans-retinal se
puede reducir hacia holo-trans-retinol, que se convierte primero en
11-cis-retinol, y después en rodopsina. Cuando los seres humanos se alimentan
con dietas con deficiencia de vitamina A, disminuye de modo gradual su
capacidad para la adaptación a la oscuridad. Hay mayor afección de la visión
dependiente de bastones que de la dependiente de conos. En el momento en que
el retinol se agota en el hígado y la sangre, por lo general a cifras
plasmáticas de retinol menores de 20 mg/dl (0.70 mM), disminuye la
concentración de retinol y de rodopsina en la retina. A menos que se supere
la deficiencia, la opsina, que carece del efecto estabilizador del retinal,
disminuye, y ocurre deterioro anatómico de los segmentos exteriores de los
bastones. En ratas bajo una dieta con deficiencia de vitamina A, sobrevienen
cambios ultraestructurales irreversibles que conducen a ceguera, proceso que
requiere uno 10 meses. Después de privación a corto plazo de
vitamina A, es posible restituir a lo normal la adaptación a la oscuridad
mediante la adición de retinol a la dieta. Sin embargo, la visión no vuelve a
lo normal sino hasta varias semanas después de que se han proporcionado
cantidades adecuadas de retinol. Se desconoce el motivo de este retraso. La integridad funcional y estructural de
las células epiteliales en todo el organismo depende de un aporte adecuado de
vitamina A. Ésta posee importancia en la inducción de la diferenciación
epitelial y el control de la misma en tejidos que secretan moco o
queratinizados. En presencia de retinol o ácido retinoico, las células
basales se estimulan para que produzcan moco. Las concentraciones excesivas
de retinoides generan una capa gruesa de mucina, inhibición de la
queratinización y aparición de células calciformes. En ausencia de vitamina A, las células
mucosas calciformes desaparecen y quedan reemplazadas por células basales que
se han estimulado para que proliferen. Esas células alteran y reemplazan el
epitelio original por un epitelio estratificado queratinizado. La supresión
de las secreciones normales conduce a irritación e infección. La reversión de
estos cambios se logra mediante la administración de retinol, ácido retinoico
y otros retinoides. |